近年来,CAR-T细胞疗法获得成功,却难以在实体瘤治疗中有显著效果,鉴于此,用自然杀伤细胞(NK细胞)替代T细胞,即CAR-NK细胞疗法,可能是一种更好的替代方案,而且有可能成为“现成”产品。NK细胞是机体的第一道防线,其具有抗体依赖的细胞毒性(ADCC)作用能自发杀伤肿瘤细胞和病原体,并参与机体的抗肿瘤免疫监视和免疫应答。本文综述了CAR-NK细胞的产生、抗肿瘤活性的机制、优势及临床试验,主要分析了CAR-NK细胞在实体瘤治疗面临的挑战及相应策略。
具有CAR结构的NK细胞的基因工程也类似于CAR-T细胞的生成。癌症患者采用CAR-NK疗法的程序如图1所示。
一、CAR-NK细胞的介绍
NK细胞因为其抗原独立,对显示特定表面特征的细胞具有强大的细胞溶解活性,独特的生物学特性、抗肿瘤机制、来源广泛、安全性高等优点,被认为是一种很有前途的CAR-T替代品。目前有不少于40项临床试验在实体瘤患者中调查过继输注NK细胞(通常与其他治疗方式相结合)的安全性和有效性 。
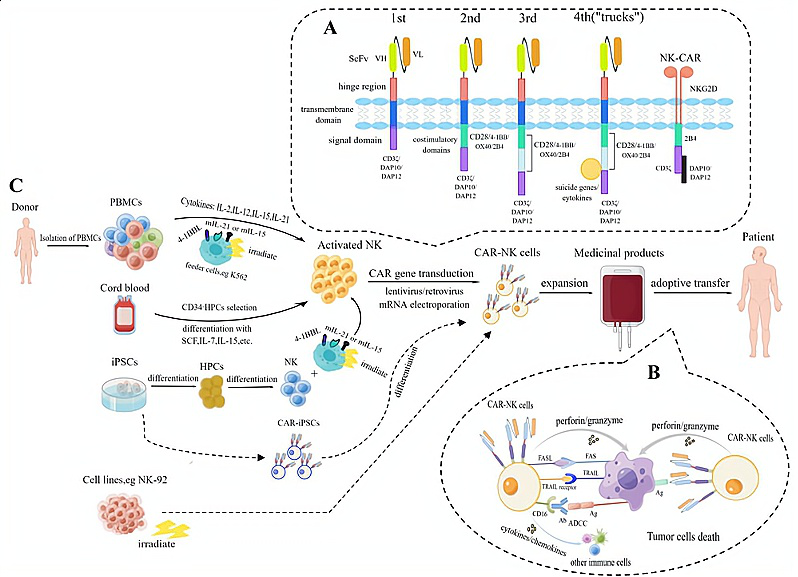
图 1 用于癌症患者过继转移免疫治疗的CAR-NK细胞产生过程
CAR-T疗法在临床试验中的成功促进了CAR-NK细胞的发展。具有CAR结构的NK细胞的基因工程也类似于CAR-T细胞的生成。癌症患者采用CAR-NK疗法的程序如图1所示。
1
CAR-NK细胞的产生
CAR-NK细胞采用T细胞设计的前四代CAR结构,由胞外抗原结合区(scFv)、胞外铰链区和跨膜区以及胞内信号转导区域组成,现在又结合NK细胞的特异性区域,使其具有更强的NK细胞激活和抗肿瘤反应,CD28和4-1BB是两个常用的经典共刺激结构域。
目前临床上使用的NK细胞主要有五种来源:人外周血(PB)、脐带血(UCB)、人胚胎干细胞(hESCs)、诱导多能干细胞(iPSCs)以及NK-92细胞系。将CAR基因导入NK细胞的途径可分为病毒途径和非病毒途径(图2)。病毒转导系统是CAR-NK转导使用的主要方法,常用的病毒载体有:狒狒包膜糖蛋白(BaEV-GP),重组腺相关病毒(AAV),CD19-CAR慢病毒等等。非病毒途径常用mRNA电穿孔法。
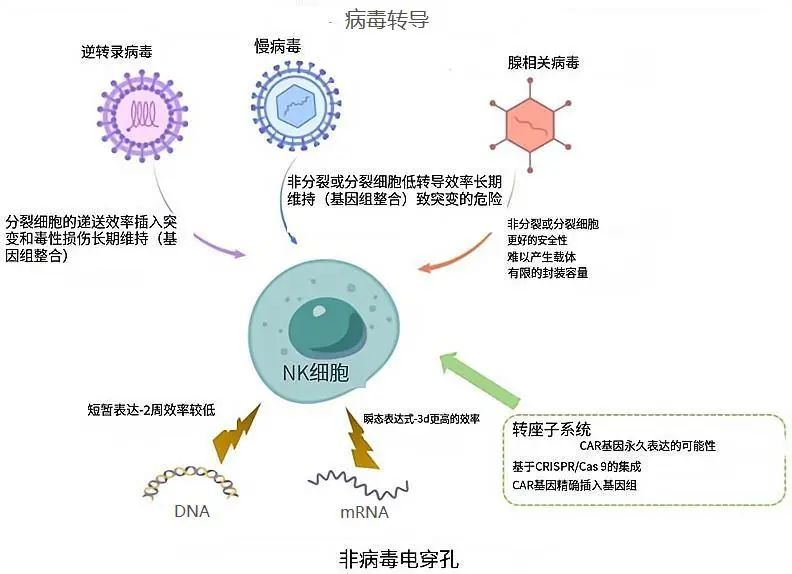
图2 将CAR导入NK细胞的多种途径。介绍了病毒转导(上)和非病毒电穿孔(下)两种NK细胞基因工程方法及其优缺点
2
癌症致死机制
NK细胞具有细胞毒性和免疫调节双重功能,具有强力杀伤肿瘤细胞的能力,且不具主要组织相容性复合体(MHC)限制性,当NK细胞接触到MHC分子下调的肿瘤细胞时,由于抑制信号的缺失可引起NK细胞对肿瘤的杀伤,同时,当某些肿瘤细胞激活信号的上调也会引起NK细胞的激活和对肿瘤细胞的杀伤。
NK细胞可以通过CAR结构的基因工程靶向杀伤肿瘤(图1B)。对于实体瘤,抗Her2和抗EGFR工程NK治疗已在胶质母细胞瘤、乳腺癌和卵巢癌等几种癌症中得到报道,其他抗原包括间皮素,PSCA, GPA7和EpCAM也可作为实体瘤CAR-NK细胞靶点。
3
CAR-NK细胞独特的优势与缺点
与CAR-T相比,NK细胞来源丰富,且CAR-NK具有更好的安全性和多种可用的细胞毒性机制,但也有很多缺点阻碍了其推广。详见表3
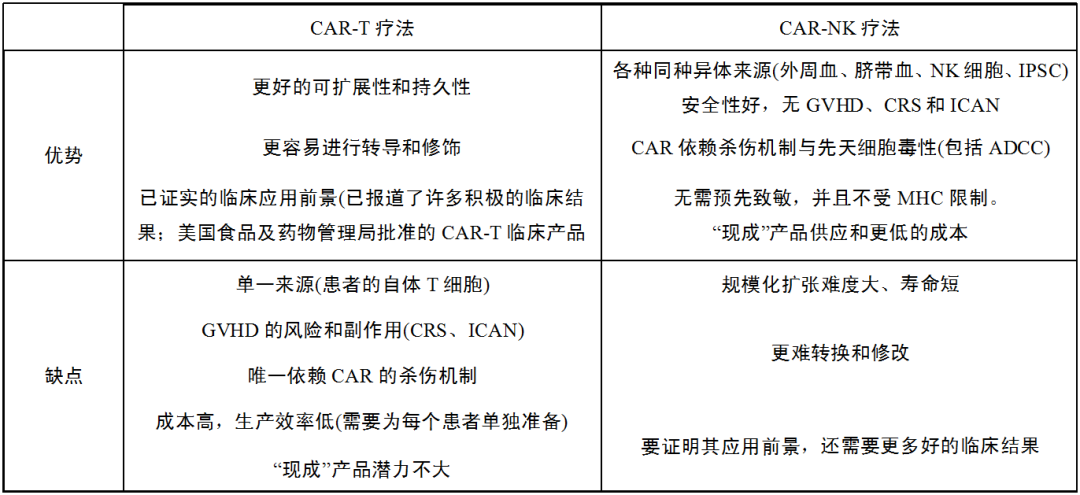
表 3 CAR-T疗法与CAR-NK疗法的优缺点比较
二、CAR-NK在实体瘤治疗的障碍及应对策略
临床结果表明,过继转移(ACT)的NK细胞在实体瘤治疗中必须满足:(1) 进入并充分渗透肿瘤微环境; (2) 较长持久性和增殖能力(3)调节强大的分泌和细胞毒功能。
(1)NK细胞的扩增和纯化
ACT需要大量具有高细胞毒性的NK细胞,但其在外周血淋巴细胞中所占比例不超过10-15%,需要体外培养扩增。将表达白介素15(IL-15)和黏附分子4-1BBL的K562饲养细胞与外周血自然杀伤细胞共培养是一种较好的方法,一项用含有IL-2、IL-21的GMP兼容培养液和照射的自体饲养层细胞进行的手动实验有效地诱导了85倍的NK细胞扩增。
同种异体NK细胞可能被T细胞污染,从而影响NK细胞的治疗。研究发现,在第一次过继转移IL-15/4-1BBL激活的NK细胞(aNK)的人体试验中,aNK-DLI可能通过增强潜在的T细胞同种异体反应而导致急性GVHD。前体淋巴细胞缺失可能有助于纯化NK细胞。
(2) CAR-NK细胞在体内的持久性
NK细胞不会大量扩增,在体内的寿命很有限,导致其持久性差。细胞因子如IL-2和IL-15是参与NK细胞功能的关键分子。IL-15在体外可刺激NK细胞增殖,上调NK细胞表面活化受体NKp30的表达。ALT-803在体内可以促进CD8+T细胞和NK细胞的增殖,且患者对它的耐受性很好。
(3)TME的抑制
NK细胞运输受损以及具有免疫抑制作用的代谢TME特征会阻止ACT NK细胞进入实体瘤的TME中,限制其持久性或抑制其细胞毒功能(图3)。
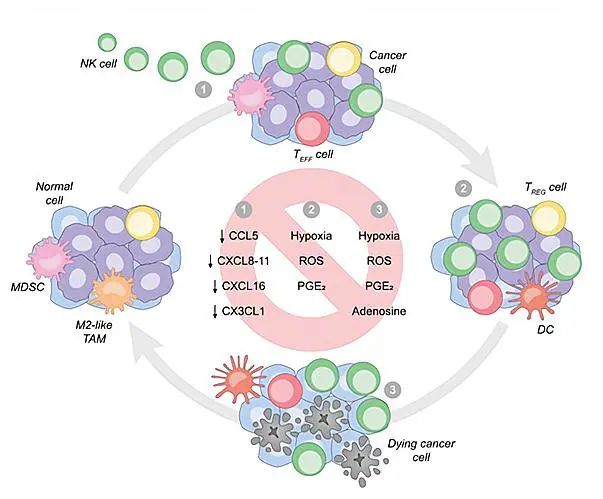
图 3 实体瘤中最佳NK细胞活性的环境障碍
(4)抗NK细胞活性的免疫和基质屏障
TME的许多免疫和基质细胞隔膜有效地抑制了NK细胞的效应功能,因此,靶向这些细胞群,如Treg细胞、肿瘤相关巨噬细胞(TAMs)、MDSCs和癌症相关成纤维细胞(CAF),可以赋予肿瘤浸润性NK细胞优越的效应功能(图4)。
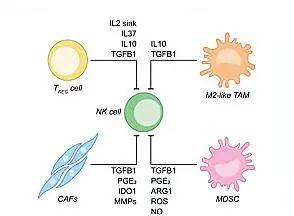
图 4 实体瘤中免疫和基质屏障对最佳NK细胞活性的影响
(5) “现成”CAR-NK细胞的储存、运输和回收
现成的CAR-NK细胞的储存、运输和回收是促进大规模临床推广所必需的,但NK细胞在解冻后,其存活率和细胞毒作用显著下调,而用IL-2培养可以改善冷冻对NK细胞的影响。此外,细胞因子激活的NK细胞对低温非常敏感,所以需要在体温下运输。适当的细胞密度在运输过程中至关重要,过高的细胞浓度可能会导致细胞活性丧失。
结 语
目前,基于CAR-NK细胞的治疗因其独特的优势和现成产品相对于CAR-T治疗的可行性而成为一个热门的研究领域,有望成为治疗癌症的一种替代细胞免疫疗法,但NK细胞用于实体肿瘤的治疗仍然受到许多障碍的阻碍,如何优化NK细胞特异性CAR结构的基因编辑技术,如何快速有效地扩增和激活NK细胞,以及如何提高TME的持久性和修复以提高实体瘤的治疗效果等问题仍需继续研究和解决。
注:本文图片均来自参考文献,如有版权问题请于本网站后台留言,我们将第一时间删除。
参考文献:
1. Tong, L., Jiménez-Cortegana, C., Tay, A.H. et al. NK cells and solid tumors: therapeutic potential and persisting obstacles. Mol Cancer 21, 206 (2022). https://doi.org/10.1186/s12943-022-01672-z
2. Wang, X., Yang, X., Yuan, X. et al. Chimeric antigen receptor-engineered NK cells: new weapons of cancer immunotherapy with great potential. Exp Hematol Oncol 11, 85 (2022). https://doi.org/10.1186/s40164-022-00341-7