引 言
全人源抗体、人源化抗体、嵌合抗体和鼠源抗体分别占临床使用的所有单克隆抗体(mAbs)的51%、34.7%、12.5%和2.8%。其中全人源单抗和人源化单抗已经成为治疗性抗体领域的主导模式。本文首先介绍抗体免疫原性,人源化技术,特别介绍了纳米抗体的免疫原性和人源化技术,随后介绍了目前生产单克隆抗体的主要技术—噬菌体展示技术。
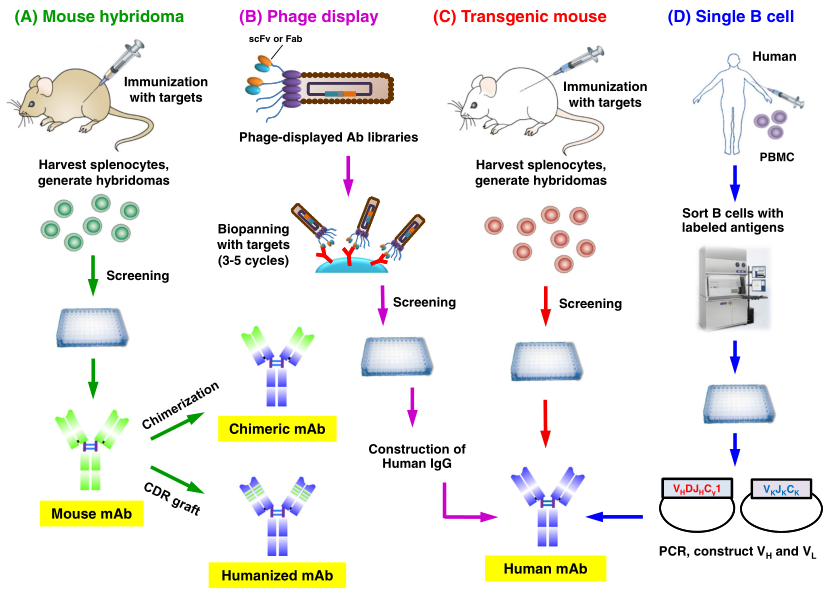
图1 治疗性抗体发现方法(图片来源:参考文献2)
治疗性抗体免疫原性
1 ► 单抗免疫原性
在临床环境中使用单抗应具有几个基本的生物物理特性,如高抗原结合活性、高稳定性和低免疫原性等。
抗体免疫原性是指宿主免疫系统对这些治疗剂的识别和反应程度。在使用抗体药物的病人身上发现免疫原性时,往往也会发现抗药抗体(ADA)。抗药抗体可能会中和治疗剂,降低药物疗效。重要的是,抗药抗体可能会进一步引起从皮疹到全身炎症反应的不良反应,这会影响抗体药物在临床上使用时的安全性和有效性。
免疫原性受到多种因素的影响,如药物剂量、给药策略(途径和组合)、杂质污染、抗体/抗原结合复合体产生的聚集体以及结构特征(序列变异和糖基化)。
人源化抗体的恒定区存在人源序列,在Fv中几乎全是人源序列,只有CDR来自小鼠移植。人源化程度更高的抗体通常在临床环境中具有更高的耐受性和更低的免疫原性。例如,Perpetua等人将人源化的抗CD52抗体与其亲代小鼠进行了比较,证明人源化显著降低了免疫原性。但人源化抗体保留了小鼠CDR,而CDR可能会被宿主免疫系统视为外来抗原,最终产生免疫原性。
全人源抗体的CDRs和框架是由人类免疫球蛋白基因谱库推导而出的,因此理论上可以避免免疫原性。然而,几种全人源抗体在给病人使用时还是会引起显著的免疫反应。如Adalimumab(阿达木单抗)是一种人类IgG1,在部分患者(5%-89%)中给药时,它可通过刺激抗独特型抗体产生显著的免疫反应。造成这些情况的原因之一是,人类抗体的Fv序列与人类生殖系存在差异。到目前为止,还没有可以准确地分析抗体的免疫原性的方法。
2 ► 纳米抗体免疫原性
VHH和VNAR具有许多理想的特性,但在作为治疗剂使用时,非人源的VHH和VNAR可能会增加不必要的免疫反应发生的机会。
然而sdAbs的一些固有特征有利于降低在人体内的免疫原性:
1
因体积较小纳米抗体会减少潜在免疫原性表位的数量。
2
纳米抗体不易形成高免疫原性聚集物
3
非半衰期延长的sdAbs具有快速血液清除能力
大多数VHHs与人类IGHV3家族基因产品的序列高度一致(在FR序列中一致性高达95%)与人源化鼠类VH域(如曲妥珠单抗)相当,预计产生免疫原性较低。
但由于鲨鱼和人类之间的进化距离,来自鲨鱼的VNARs与人类的VH和VL结构域在序列上几乎没有相同之处(总体上约为30%),因此可以预测它是所有sdAbs中免疫原性是最大的。
虽然VHHs的CDR1和CDR2环与人类抗体典型结构类似,但其较长的CDR3环可能具有人类没有的构象。VHH CDRs和FRs的高水平体细胞超突变可能有助于减少它们与人类IGHV3基因产品的序列同源性。
免疫原性构象表位也可能是由sdAb结构的微妙变化形成的,这些微妙变化是由非经典的二硫连接形成的。抗sdAb ADAs也可能比针对全尺寸常规IgG产生的ADAs更容易被中和,因为根据定义,它们必须针对可变结构域中的表位,包括形成抗原结合位点的区域。
截至2020年,至少开展了35项,涉及1000多名患者和健康志愿者的基于VHH的生物药物的临床试验。
大多数试验显示,VHH与全人源或人源化IgG的免疫原性相当,没有或只有极少的免疫原性。在一项用于乳腺癌PET/CT成像的68Ga标记的抗HER2单克隆抗体的I期试验中,20名患者在一次注射后没有出现ADA。ALX-0141(由两个相同的抗RANKL人源性VHH和一个抗白蛋白人源性VHH组成的三聚体抗体)的I期研究显示,在42名健康志愿者中,单次皮下注射后没有发现ADA。
考虑到免疫原性的限制,人们对开发全人源的sdAbs(VHs或VLs)有很大兴趣。自主的VHs/VLs并不作为人类抗体库的一部分天然存在,而是必须使用各种技术进行合成设计。以噬菌体展示技术为代表的体外展示技术,一直是发现sdAbs的关键平台。
人源化单抗的生产
1 ►人源化单抗开发进程
得益于鼠源单抗成本低廉、生产周期短等优点,鼠单抗人源化已进行大规模实施。没有经过人源化的鼠源单抗在治疗中有很多不足。如用鼠源单抗治疗的患者会产生人抗鼠抗体(HAMA)反应。HAMA不仅会提升鼠源单抗清除率,还可能产生过敏反应。此外,患者对小鼠片段结晶区(Fc)的反应激发抗体依赖性细胞毒性(ADCC)的能力有限。而人源化单抗能在有效发挥效应功能的同时,降低鼠源抗体的免疫原性。
只有轻链和重链来自小鼠CDR的人源化单抗于1988年首次进入临床开发。CDR移植是生产人源化单抗最流行的技术之一。利用这项技术,非人类CDR序列能被移植到人类序列框架中,从而让抗体保持与目标抗原的结合活性。1997年,FDA批准了第一个CDR嫁接的人源化单抗Daclizumab,它能与IL-2受体结合,用于防止移植排斥反应。在开发daclizumab中,不仅进行了CDR移植,而且还利用了与鼠源框架区同源性最大的人类框架,以减少抗原识别过程的损失。
在某些情况下,小鼠框架中的某些特定氨基酸对维持抗体结合活性至关重要。这些残基可以与CDRs协同呈现抗体副表位,或直接与抗原反应。目前,这些关键的骨架残基可以通过X射线结晶学、冷冻电子显微镜和计算机辅助蛋白质同源模拟观察抗体复合体的结构来鉴定,然后可以考虑在CDR嫁接的人源化抗体中通过‘human back to mouse'突变来恢复框架中的氨基酸位置,从而提高最终产物的亲和力和稳定性。
已经开发了多种方法来量化mAbs可变区的人源化程度。如Abhinandan和Martin设计了一种名为H-Score的工具来评估抗体序列的人源化程度,该工具计算了与人类可变区序列数据库的子集相比平均序列的同一性。
人源化抗体的使用极大地提高了单抗疗法的临床耐受性。这种对抗体序列的复杂控制能力为工程单抗在医学上广泛应用提供了可能。目前,用于治疗人类的单抗中有一半是嵌合或人源化的(图2)。
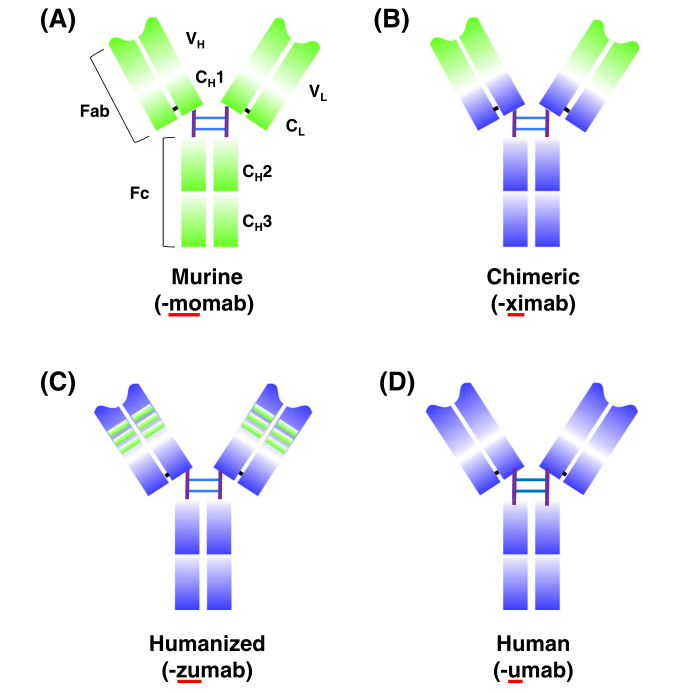
图2 小鼠抗体(绿色结构域)到全人源抗体(橙色结构域)以及相关抗体人源化的示意性概述。a 鼠源单克隆抗体。b 嵌合单克隆抗体:可变区是小鼠来源,其余链是人源。CH:重链恒定区;CL:轻链恒定区;Fab和Fc:蛋白质分解产生的片段;VH:重可变区;VL:轻链可变区(图片来源:参考文献1)
用于治疗人表皮生长因子受体2(HER2)阳性的转移性乳腺癌和胃食道交界腺癌的曲妥珠单抗(Herceptin)是最著名的人源化抗体之一,该药于1998年获得批准,2018年实现了超过70亿美元的年销售额。
2 ► 利用噬菌体展示技术制备人源抗体
噬菌体展示技术是最早也是应用最广泛的体外抗体筛选技术。噬菌体展示技术最初由George
P. Smith在1985年发明。Smith G
P第一次将外源基基因插入丝状噬菌体f1的基因Ⅲ,使目的基因编码的多肽以融合蛋白的形式展示在噬菌体表面,从而创建了噬菌体展示技术。噬菌体展示的抗体库已被证明是鉴定有效的、完全人源性单抗的可靠发现平台。
从噬菌体展示文库中识别单抗的过程始于抗体库的构建(图3A)。
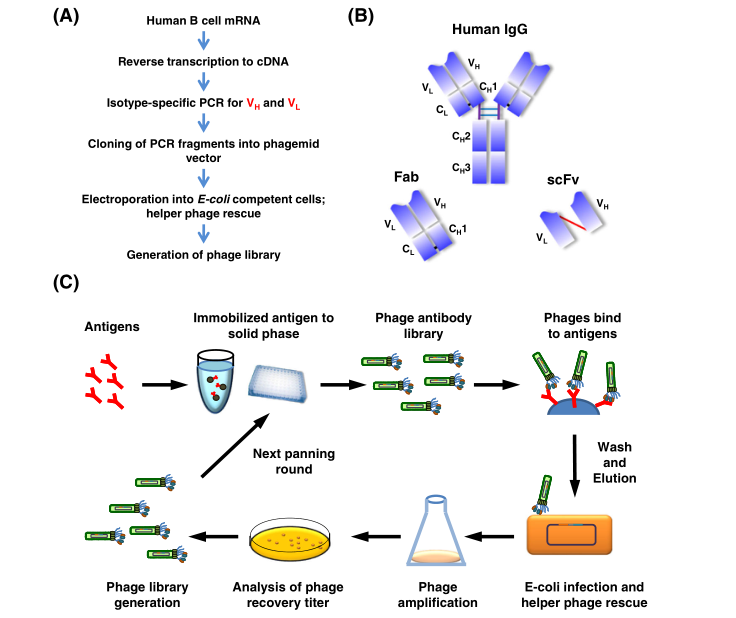
图3 噬菌体展示抗体库构建和亲和力选择 a 构建噬菌体显示抗体(Fab或scFv)库的程序概要。b IgG分子的结构。Fab由轻链和重链的前两个结构域组成。scFv由可变重链(VH)和可变轻链(VL)结构域组成,由一个短的柔性多肽连接子连接。c 用噬菌体展示的库进行生物筛选。噬菌体表面的初始抗体库被用来固定固体表面抗原,如ELISA板或磁珠。非特异性的噬菌体通过严格的洗涤被去除(图片来源:参考文献2)
代表免疫球蛋白基因编码库的重链可变区(VH)和轻链可变区(VL)聚合酶链式反应(PCR)产物被连接到噬菌体展示载体中。人外周血单个核细胞(PBMCs)中的mRNA被逆转录成cDNA。然后使用特定的引物扩增不同的VH和VL链区基因,以扩增Ig谱系内所有转录的可变区。
噬菌体展示文库中抗体的形式可以是scFv或Fab片段(图3B),scFv由VH和VL结构域通过一个短的柔性连接子连接组成。展示在噬菌体外壳蛋白上的抗体Fab片段具有相对较高的结构稳定性,并且可以很容易地转化为完整的Ig抗体,通常不会损害结合活性。
噬菌体展示文库的一大优势在于通过噬菌体颗粒将抗体表现型(特异性和敏感性)与基因型(遗传信息)联系起来。得益于噬菌体体积小和高溶解度(1013 particles/ml),可在单个库中有效产生和展示1011个独立克隆的谱系大小。
噬菌体展示文库的基因库可以从天然或免疫的动物中获得,或者可以使用随机CDR序列在固定的框架内来构建合成文库。由于基因序列来自人类捐献者的B细胞,因此天然库相对接近人类抗体生殖系,免疫原性风险较低。
与天然库相比,免疫库的主要优优势在于免疫库中的抗体基因在体内经历了亲和力成熟,从而能够开发出针对靶点的高亲和力抗体。然而,这种方法要求目标抗原能够成功地诱导免疫原性反应,并且必须为每个新的靶点准备新的文库。
大容量天然文库和合成库能产生了针对广泛靶点的高亲和力抗体(亚纳摩尔范围)。因此,非免疫文库具有明显的优点,避免了免疫小鼠出现的免疫耐受问题,而且它们不需要为每个新的靶点都建立新的免疫文库。目前,几乎所有商业文库都基于高度多样化的非免疫库,这些库能选择能靶向大范围靶点的抗体。
行业前瞻:纳米抗体人源化
1 ► 纳米抗体特性有利人源化
单域抗体(sdAbs)是骆驼和鲨鱼重链抗体的可变区,作为生物药物的组成部分,具有许多理想的特性。然而,它们的序列可能会增加人类的免疫原性和抗药抗体(ADA)的风险,因此,sdAbs在开发时通常会进行人源化。
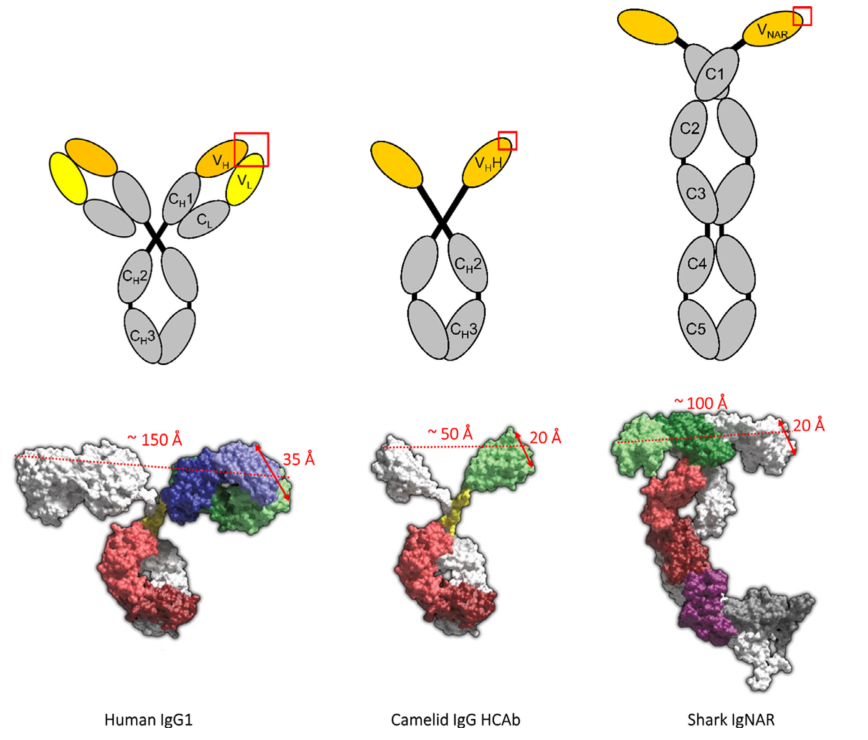
图4 传统脊椎动物四聚体Ig G1、仅骆驼重链Ig G和鲨鱼Ig NAR的结构域。抗体分子的可变区用黄色表示,抗原结合部位用红色方框表示。(图片来源:参考文献1)
sdAb的一些特性,包括骆驼科动物的VHHs与人类IGHV3基因具有高同源性,有利于人类的低免疫原性,大多数临床试验表明sdAb的免疫原性很小,但单纯的非人类序列并不能充分解释sdAb的免疫原性,因为一些骆驼科动物的VHHs是无免疫原性的,而一些全人源的VHHs却能引起ADA。
sdAb人源化会减少还是促进免疫原性仍不清楚。将通过进一步研究确定VHH和VNAR人源化的阈值,以在避免因聚集或稳定性降低而导致结合亲和力与免疫原性损失的同时,最大限度地提高人源序列含量。
2 ► 纳米抗体人源化方法
已有不少研究人员尝试人源化纳米抗体。Vincke等人撰写了第一份描述VHHs人源化的详细报告。他们选择NbHuL6(一种对人类溶菌酶有特异性的VHH)和NbBcII10(一种对蜡样芽孢杆菌的BcII布拉氏菌酶的强效VHH抑制剂),作为人源化的测试案例。
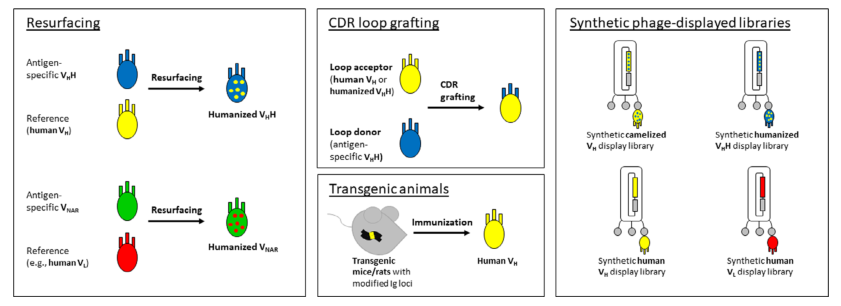
图5 降低sdAbs免疫原性的主要策略。i:骆驼VHH和鲨鱼VHAR可以通过使用同源的人类可变区作为参考进行表面重塑(resurfacing)。ii:VHH/VNAR也可以通过将其CDR嫁接到合适的受体支架上来人源化(要么是先前人源化的VHH/VNAR,要么是全人VH然后反向突变)。人源化的替代方法包括使用噬菌体展示文库技术和转基因小鼠/大鼠,转基因小鼠/大鼠产生灭活的内源性抗体,敲入包含自主VH、D和JH基因片段的IgH基因片段,以及缺乏CH1外显子的恒定区基因。(图片来源:参考文献1)
作者基于实验结果提出了两种生成具有最佳稳定性和亲和力的人源化VHHs策略。首先是将CDR移植到 “通用 ”人源化VHH支架上,即h-NbBcII10FGLA,这通常会产生具有良好表达能力、高稳定性和可溶性以及保留亲和力和特异性的人源化VHHs。如果这种策略导致了亲和力损失,可以采用第二种重塑方法,即人源化第49和50位,但不改变第42和52位。(注:IMGT positions 42、49、50和52是四个关键的FR2增溶残基位置)。
基于Vincke等人的Protocol,Ben Abderrazek团队、Kazemi-Lomedasht团队、Rossotti团队、Yu、Li等团队都对VHH人源化进行了有益尝试,皆取得了不同程度的结果发现。
总而言之,sdAb人源化进程复杂程度各异,成功率难以预估,所以目前已经开发了一些策略来规避人源化。这些技术主要分为三类:
(a)使用人源化或完全人源化的sdAb支架构建合成sdAb库。
(b)将VHH和具有VHH序列特征的稀有分子分离。
(c)利用转基因动物产生具有完全人类可变结构域的HCAbs。
结 语
噬菌体展示技术已被证明是产生全人源抗体的可靠方法。大容量(>1010)、高质量(抗体多样性丰富)的噬菌体抗体库对成功识别治疗性mAbs至关重要。此外,从噬菌体展示库中的最佳选择取决于目标抗原的质量、抗原的固定化以及对结合和洗涤条件的严格控制。目前,已有9种从噬菌体库中发现的全人类抗体被批准用于治疗,还有几十种噬菌体衍生的抗体治疗药物正在进行临床试验,等待进入市场。
而针对纳米抗体人源化,还需要做更多的工作来确定VHHs和VNARs人源化的最佳策略,以便在不影响亲和力、稳定性或溶解性的情况下,最大限度地提高人源序列的含量,因为这些参数的细微变化可能对免疫原性产生不可预测的影响。
参考文献:
1.Rossotti MA, Bélanger K, Henry KA, Tanha J. Immunogenicity and humanization of single-domain antibodies. FEBS J. 2022 Jul;289(14):4304-4327. doi: 10.1111/febs.15809. Epub 2021 Mar 25. PMID: 33751827.
2.Lu RM, Hwang YC, Liu IJ, Lee CC, Tsai HZ, Li HJ, Wu HC. Development of therapeutic antibodies for the treatment of diseases. J Biomed Sci. 2020 Jan 2;27(1):1. doi: 10.1186/s12929-019-0592-z. PMID: 31894001; PMCID: PMC6939334.